行业动态首页 > 新闻动态 > 行业动态
三阴性乳腺癌(triple negative breast cancer,TNBC)是指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性的乳腺癌。TNBC与其他类型乳腺癌相比,预后较差,死亡风险较高,治疗手段以化疗为主。临床迫切需求发现新的分子靶点,开发低毒性的药物来治疗TNBC患者。
近期,温州医科大学教授团队与温州医科大学第一附属医院合作,对osthole在TNBC细胞中的作用进行研究。研究表明osthole可以通过结合STAT3抑制TNBC细胞的生长并促进其凋亡,为潜在治疗TNBC的新药物提供支持,STAT3有可能成为新型抗TNBC药物开发的靶点。相关研究结果在《Journal of Experimental & Clinical Cancer Research》(IF=6.2)发表。
1. Osthole对TNBC细胞的影响
已有报道指出,osthole在人类的癌症中具有抑癌作用。为了研究osthole在乳腺癌细胞中是否具有类似的作用,研究人员对osthole处理下TNBC细胞的生存能力和生长情况进行评估。发现在osthole处理下,TNBC细胞的存活率降低,而且TNBC细胞中MDM2, Cyclin B1和 CDC2的表达水平下降,这表明osthole可抑制TNBC细胞的生长,促进TNBC细胞活的凋亡并引起细胞周期阻滞。
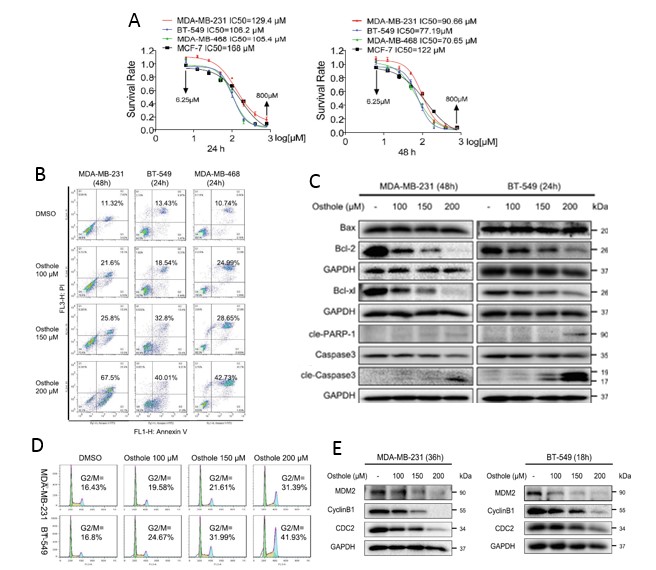
图1. Osthole抑制TNBC细胞的生长
(A)Osthole对人TNBC细胞活力的影响;(B)osthole处理下后TNBC细胞凋亡检测;(C)MDA-MB-231和BT-549细胞分别用osthole处理48h和24h后,WB检测凋亡相关蛋白;(D)采用PI染色和流式细胞术检测TNBC细胞周期阻滞的诱导作用;(E)MDA - MB - 231和BT - 549细胞用200μM osthole 处理36 h和18 h,WB检测G2/M细胞周期相关蛋白MDM-2、Cyclin B1、CDC2水平。
2. Huprot蛋白芯片筛选潜在结合靶点
为了确定osthole抑制乳腺癌的机制和靶点,研究人员利用高通量的蛋白质组学研究工具---Huprot人蛋白质组芯片,对osthole的结合蛋白进行筛选,发现了199个与osthole结合的蛋白。对这些蛋白进行生物学分析,研究人员发现在这些蛋白中,STAT3在多种恶性肿瘤中被异常激活且其可促进癌细胞的凋亡。因此,研究人员推测STAT3可能是osthole在TNBC细胞中产生抑制作用的潜在靶蛋白。
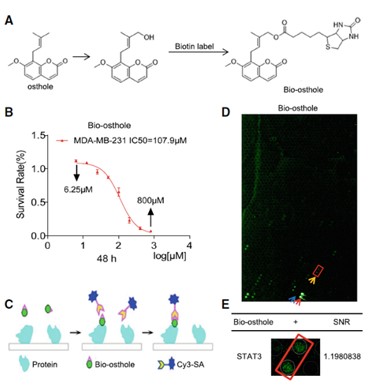
图2. Huprot蛋白芯片筛选osthole结合蛋白
(A)生物素标记osthole;(B)生物素化osthole活性测定;(C)芯片反应模式图;(D)芯片反应荧光图;(E)放大后STAT3蛋白斑点图。
3. Osthole对STAT3的活性影响
研究人员评估了STAT3在TNBC细胞中的活性,研究表明在MDA-MB-231和BT-549细胞系(图4 A和B)中 STAT3磷酸化水平(p-STAT3) 是高基底的,细胞暴露在osthole下会减少p-STAT3的水平,但并不是时间和剂量依赖性,这些发现表明osthole可能通过直接结合STAT3而抑制其活性。
Western blot检测发现osthole以剂量依赖性的方式抑制IL-6诱导的p-STAT3(图4c)。此外,从细胞中提取的核提取物显示,暴露于IL-6和osthole的MDA-MB-231细胞中,细胞核STAT3水平降低(图4e)。这些结果表明,osthole能有效地阻止STAT3的活化和核易位。
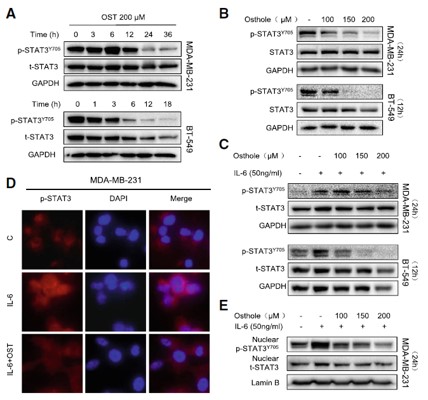
图3. Osthole抑制TNBC细胞中STAT3的磷酸化
(A) MDA - MB - 231和BT - 549细胞在200 μM osthole处理下的P-STAT3水平测定;(B)MDA-MB-231和BT- 549细胞在不同浓度osthole 处理24小时和12小时的P-STAT3水平测定;(C)细胞在200 μM osthole 处理24 h(MDA - MB - 231)或12 h(BT - 549)后用IL-6 (50 ng/mL)刺激30分钟,WB检测STAT3磷酸化情况;(D)细胞免疫荧光染色显示MDA-MB-231细胞中P-STAT3(红色)的分布;(E)MDA-MB-231细胞经osthole预处理24 h后暴露于IL-6 (50 ng/mL) 30 min,核提取物经WB检测P-STAT3和STAT3。
4. 过表达STAT3
在MDA-MB-231细胞中过表达STAT3,增加STAT3的磷酸化水平,结果显示过表达STAT3可以逆转osthole诱导的细胞凋亡和细胞周期阻滞,这说明在TNBC细胞中osthole的抑制作用是通过抑制STAT3发挥功能的。
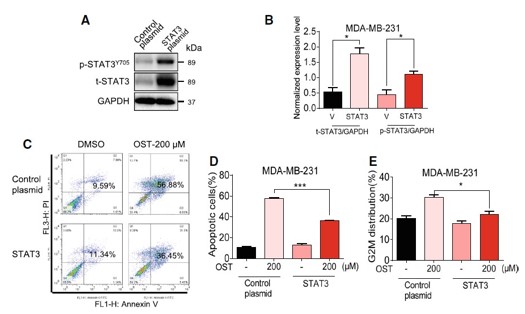
图4. 过表达STAT3可降低MDA-MB-231细胞中osthoper介导的细胞毒性作用
(A)转染STAT3质粒后MDA-MB-231细胞中STAT3和P-STAT3水平;(B)STAT3蛋白水平的定量;(C)STAT3 过表达细胞和空载转染细胞,暴露在200 μM osthole 48 h,流式细胞术检测凋亡细胞;(D)凋亡细胞百分比定量分析;(E)STAT3过表达细胞和空载转染细胞,暴露在200 μM osthole 36 h,流式细胞术测定G2/M细胞周期 (* P < 0.05)。
5. 动物实验验证
为了确认在体内osthole是否可以抑制TNBC的生长以及这种抑制作用是否与STAT3有关,研究人员在裸鼠中使用MDA-MB-231乳腺癌细胞进行异种抑制并进行相关研究。结果表明,osthole可通过抑制STAT3有效抑制肿瘤细胞的凋亡和周期阻滞。
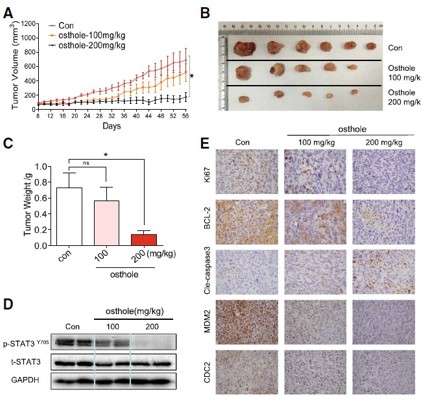
图5. Osthole在体内抑制MDA-MB-231异种移植生长
(A)Osthole治疗组小鼠和对照组肿瘤体积比较;(B)第48天切除的肿瘤组织比较;(C)第48天肿瘤重量测定;(D)WB检测切除肿瘤标本的P-STAT3水平;(E)肿瘤切片免疫组化染色。
小结:
该研究确定了Osthole对TNBC细胞的抗肿瘤活性以及其潜在的机制,证明Osthole可作为治疗TNBC新的候选方案,而STAT3可能是新型抗TNBC药物开发的靶点。
参考文献:
Dai X , et al., Osthole inhibits triple negative breast cancer cells by suppressing STAT3[J]. Journal of Experimental & Clinical Cancer Research, 2018.
博翀生物HuProt蛋白芯片介绍:
