行业动态首页 > 新闻动态 > 行业动态
转移性乳腺癌(MBC)是一种极具侵袭性的三阴性乳腺癌(TNBC),MBC的特征是存在腺上皮成分和非腺化性成分,这些成分可能由梭形细胞、鳞状细胞和肉瘤样细胞组成(即软骨样或骨样)。在临床上,MBC比非转移性的TNBC更具有转移性和耐药性,其中梭形亚型预后最差。然而MBC病理亚型和转移行为的蛋白质谱尚不清楚。本篇文章阐述的是今年发表在《Nature Communications》上的一项关于应用蛋白定量技术进行乳腺癌疾病的研究。
在本研究中,研究者使用MBC,TNBC和正常乳房的人体组织样本以及定量定制平台来测试以下假设:MBC的组织学亚型可能具有不同的蛋白质谱,这可能导致其病理表型多样性和侵略性临床行为。通过揭示MBC中的蛋白质特征及其与TNBC和正常乳腺组织的关系,本研究增强了对MBC生物学的理解,并提供了潜在的诊断和预后标志物,以及针对MBC病理亚型的可治疗靶标。
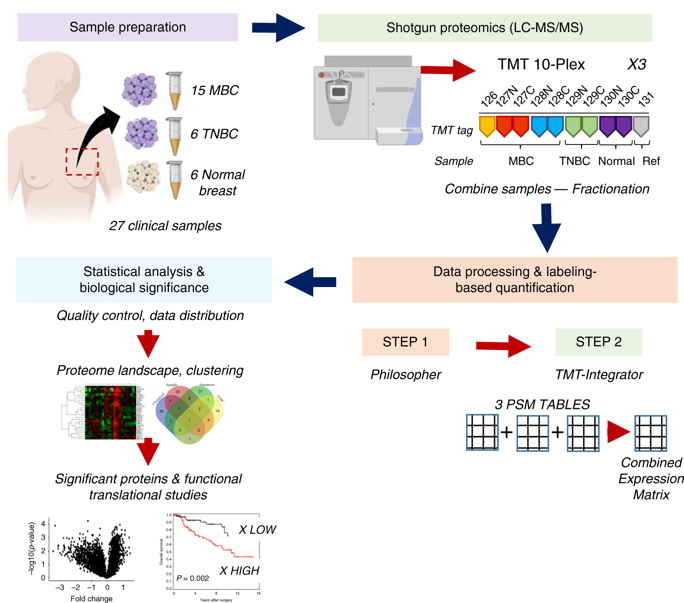
图1 定量蛋白质组学工作流程
(Sabra I,et al. Nature Communications.2018.)
研究内容
01人体样本和临床数据
为了阐明MBC的蛋白组学特征,并了解其与TNBC和正常乳腺组织的蛋白表达差异,本研究中使用了15例冰冻MBC的临床队列,根据其主要的转移性成分在临床上将其分为以下亚型:梭形(n=6),鳞状(n=4),和肉瘤样(n=5)。此外,本研究队列中还纳入了6例非转移性TNBC和6例正常的相邻乳腺组织。所有患者均为女性,平均年龄55岁(33~89岁)。
MBC的大多数(15个中的14个,占比93.33%)以及所有TNBC的组织学等级均为3,雌激素和孕酮受体均为阴性,HER2/neu过表达。在诊断时,这15个MBC中有11个(78.6%)为I/II期,有3个(21.4%)为III/IV期。在诊断的6例TNBC中,有5个(83.3%)为I/II期,有1个(16.6%)为III期。随访时,TNBC 14个中有4个(28.6%),TNBC 6个中有1个(16.66%)发生了远处转移至肺、肝、皮肤和骨骼。
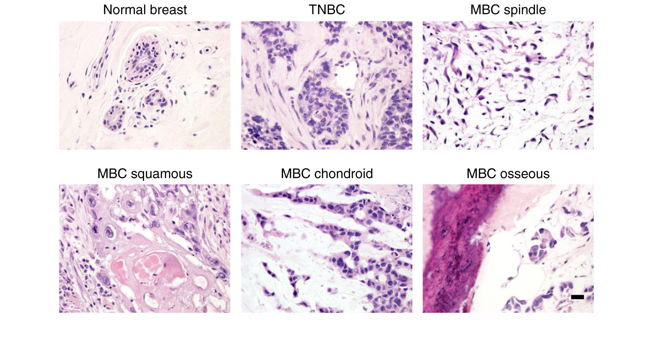
图2 人类临床样本组织切片
(Sabra I,et al. Nature Communications.2018.)
02人转移性乳腺癌的蛋白质组
研究者利用多路复用的TMT 10-plex蛋白质组学,以及自动化的、强大的计算数据分析体系,生成了27个人体组织样品的定量蛋白质组图谱。研究者将样本分为了适合10-plex TMT同标策略的三个实验组(每组10个样本,包括27个组织中的9个组织样本和1个参考样本)。三个蛋白质组TMT 10- plex实验分别鉴定了82251、84667和84386个肽段,所有样本的特异性蛋白深度为5798个(1%蛋白和1% PSM错误发现率)。之后,研究者使用MSFragger 和Philosopher tools进行了肽识别、蛋白质推断、FDR筛选,从原始数据中提取量化信息,使用TMT-Integrator进行附加的质量评估和过滤、PSM选择、离群值去除、肽到蛋白的定量、并进行归一化处理(图1)。
所有患者样本的分布和主成分分析(PCA)显示出正常乳腺和肿瘤蛋白组之间的明显区别(图3)。MBC和TNBC蛋白质组间的无监督k-means聚类方法和分级聚类显示出MBC亚型和TNBC之间的适度差异,后者与梭形和鳞状MBC重叠最多(图3)。此外,15个MBC样本中有1个被排除在下游分析之外,因为组织学和蛋白质组学证实,用于分析的切片只包含正常组织。
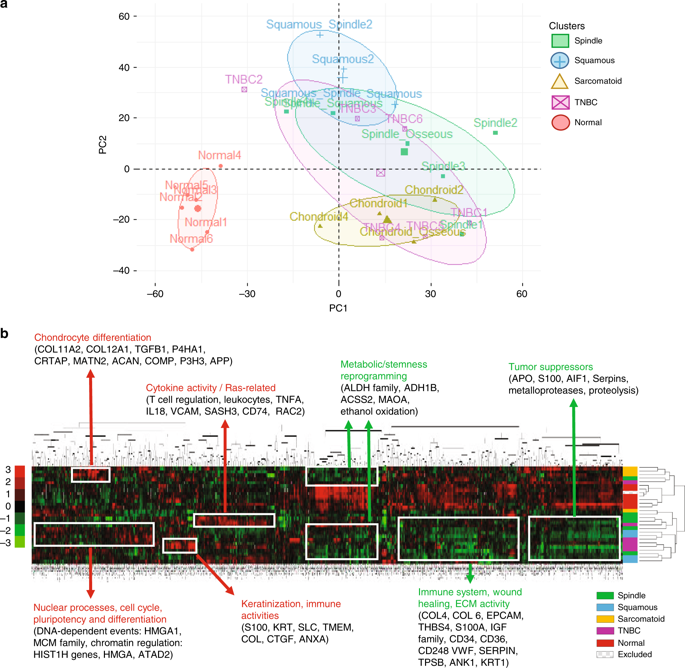
图3 MBC、TNBC和正常乳腺组织的定量蛋白质组学
(Sabra I,et al. Nature Communications.2018.)
根据聚类分析,相对于正常组织,MBC蛋白组总体特征中显示出了一个整体的下调,涉及主要肿瘤抑制因子、细胞外基质活性和伤口愈合反应(图3)。而富集分析显示MBC上调的蛋白的顶部GO分子功能是原胶原-脯氨酸双加氧酶活性,下调的蛋白顶部GO分子功能是醛脱氢酶活性。MBC蛋白质组具有功能相关性,即MBC肿瘤和正常组织具有不同的蛋白质谱并显示出致瘤途径的失调。
03 MBC以及MBC亚型间的蛋白组
接下来,研究者对MBC组织病理学亚型与特定蛋白组学特征间的关联性进行了分析。根据组织学MBC亚型对患者样品进行分组,其中具有混合特征的样本被分组为属于其主要组织学的亚型(如将具有部分梭形特征的鳞状细胞分为鳞状细胞亚群),并对MBC相对于TNBC、跨MBC亚型的差异表达进行分析(图4)。与TNBC相比,MBC显示免疫系统失调(体液免疫反应;p <1e−04)和细胞外结构组织的特征。
本研究还揭示了MBC亚型中不同的功能过程,如鳞状细胞中丰富的角化作用(表皮细胞和角化细胞分化)、梭形细胞中蛋白水解和蛋白活化级联的调节、肉瘤样细胞中白细胞活化和胞吐作用(图4)。这些结果揭示了MBC蛋白质组中常见的以及不同的细胞分化特征。

图4 组织学上MBC亚型的差异表达分析
(Sabra I,et al. Nature Communications.2018.)
为了更好地了解MBC病理亚型之间的功能差异,并阐明潜在的独特蛋白特征,研究者使用hallmark、经典通路、GO数据集,从MsigDB数据库应用基因集富集(GSEA)分析(图4)。与TNBC相比,MBC中最顶端的上调特征是EMT,而氧化磷酸化(OXPHOS)是最顶端的下调标志通路(图5)。
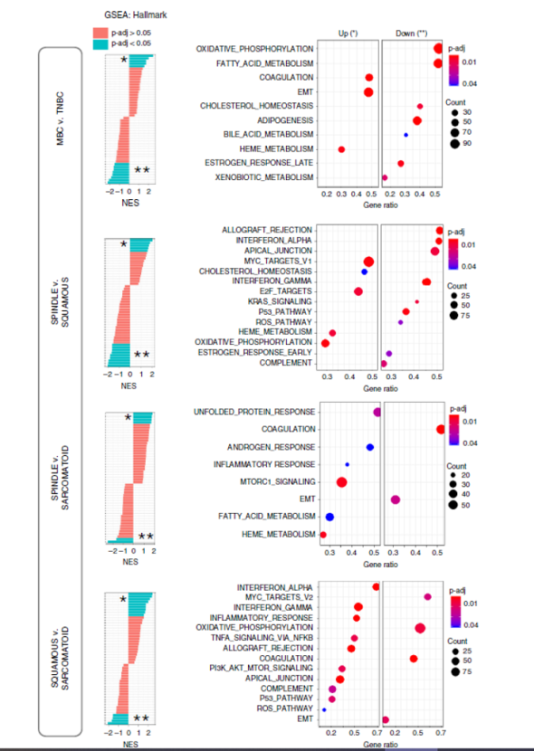
图5 GSEA揭示了MBC内以及MBC相对于TNBC的标志通路
(Sabra I,et al. Nature Communications.2018.)
GSEA hallmark分析揭示了MBC亚型之间不同的上调和下调的蛋白谱(图5),GSEA富集图描绘了差异最大的通路的具体差异(图6)。病理亚型之间的比较表明,梭形MBC具有较高的MYC和E2F靶标,以及核糖体途径蛋白;鳞状MBC具有较高的干扰素γ(和广泛的炎症反应)、TP53和PI3K信号传导、顶端连接,低的OXPHOS、MYC和E2F靶点;而肉瘤样MBC具有高的EMT和OXPHOS,低干扰素γ、MTORC1和PI3K信号(图4、5)。通过蛋白网络显示了顶部富集的上调和下调的通路及其相关蛋白的可视化,这可能可以作为潜在的治疗候选进行研究。通过对每个MBC相对于TNBC的其他的差异表达分析,进一步验证了这些上调和下调的蛋白特征。总之,与TNBC相比,这些分析确定了MBC中可能起作用的特定通路,并强调了MBC亚型的特异性通路,以供进一步的功能研究。
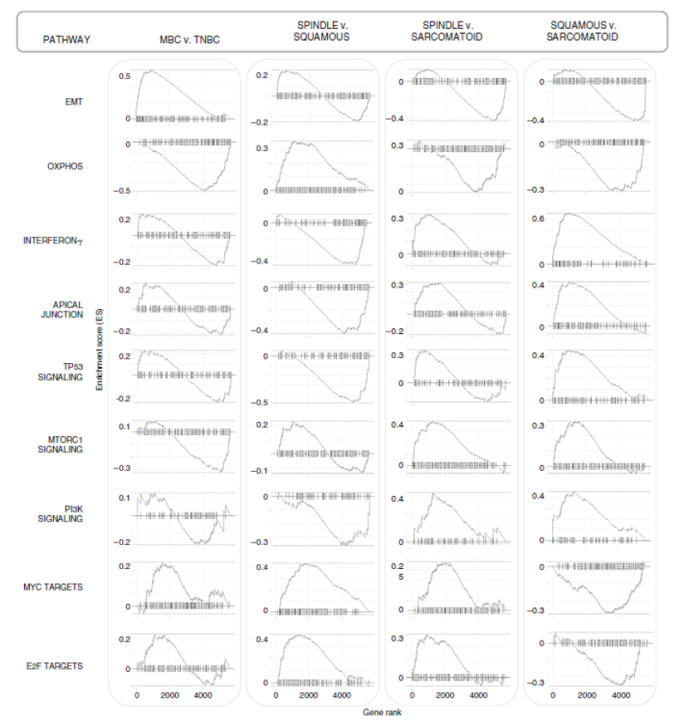
图6 顶部的富集通路谱可以区分MBC亚型和TNBC
(Sabra I,et al. Nature Communications.2018.)
04 MBC亚型特定的突变特征
基于MBC中发现的亚型特异性标志蛋白途径,对每个途径可能表现出不同的DNA突变谱这一假说进行阐述。在15例MBC肿瘤中,对10对肿瘤及其正常组织的配对样品进行了初步的全外显子组测序(WES)的质量控制(图7)。观察到的大多数变体是内含子(图 7a),当仅筛选错义和功能丧失或LoF(图 7b)时,发现MBC在TP53(70%)、MUC17(60%)、PLEC(30%)、CRYBG2(40%)和ZNF681(30%)中均有较为频繁的体细胞突变(图 7c)。梭形和鳞状肿瘤都有AHNAK突变(梭形为AHNAK,AHNAK2(80%); 鳞状是AHNAK(33%),AHNAK(67%)和PI3K家族突变梭形中PIK3C2A(20%);鳞状里PIK3CA(33%)。鳞状MBC在MTOR、NOTCH3和PTEN中也有突变(33%)。
肉瘤样MBC显示钙粘蛋白、钙离子和WNT信号的遗传改变,在原钙粘蛋白基因簇(PCDH家族)和CDH7、MAP3K2和FAT1中频繁突变(50%)(图7b,e)。此外,所有亚型的变体中等位基因频率是相似的(图7d)。综上所述,这些数据表明MBC在5个基因中共享突变,其中只有TP53之前报道过。这些数据还显示,肉瘤样MBC与梭形和鳞状肿瘤的突变谱有明显的差异,突出了蛋白质组学在病理亚型区分中的重要性,这为阐明这些肿瘤的生物学机制和功能研究铺平了道路。
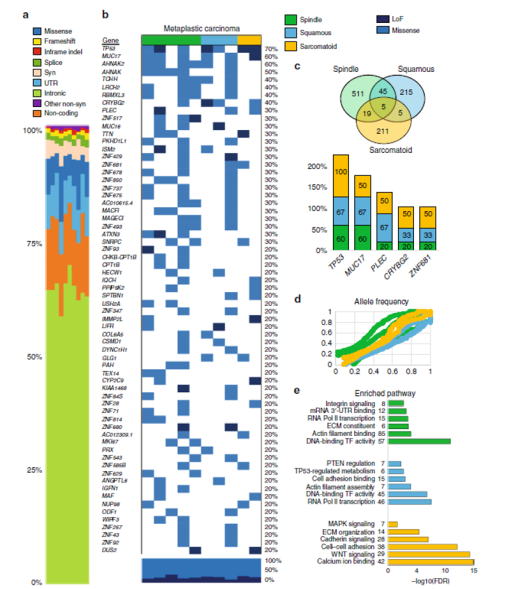
图7 WES分析显示了MBC的体细胞突变库
(Sabra I,et al. Nature Communications.2018.)
05人和小鼠MBC蛋白组的比较
为了进一步细化梭形MBC的蛋白质谱并确定人与小鼠肿瘤之间常见的失调蛋白,研究者对MMTV-Cre; Ccn6 fl/fl小鼠的梭形MBC肿瘤进行了定量蛋白质组学,然后与人MBC蛋白质组进行了比较(图8a-c)。与正常小鼠乳腺相比,MMTV-Cre; Ccn6 fl/fl小鼠肿瘤显示出增加的MYC,E2F,未折叠的蛋白应答和核糖体途径蛋白,这与人纺锤体MBC相似(图8d)。
基于共同的病理、转移能力和信号通路,假设人类和小鼠梭形MBC肿瘤可能有重叠的蛋白特征。GO注释和STRING数据库中的富集分析揭示了一个36种蛋白质的集合,其中17种上调和19种下调在人类和小鼠梭形MBC蛋白质组之间重叠(图8e)。共有的下调蛋白在包括氧化还原、羧酸和乙醇代谢在内的代谢过程中起作用(例如ALDH1L1、ADH1B、ADH1C、SOD1、LIPE、FABP4)。上调蛋白包括参与核糖体功能、翻译和RNA代谢的蛋白(例如RPL18A,RPL18,RPL6)。此外,还发现上调蛋白之间存在高度富集的蛋白-蛋白相互作用网络(p<1e-16)。总之,这些数据描述了在人类和小鼠肿瘤的梭形MBC中显著失调的通路,并指定了可能可以作为标记物和治疗靶标的蛋白质集。
总而言之,本研究对MBC进行了蛋白质组学分析,对其与非转移性TNBC的蛋白组进行了比较,并进行了梭形、鳞状和肉瘤样这三个不同亚型之间的分析。对MBC的特异性通路进行了阐明,为进一步分析提供了信息,并得到了可能可以作为标记物和治疗靶标的蛋白质集。
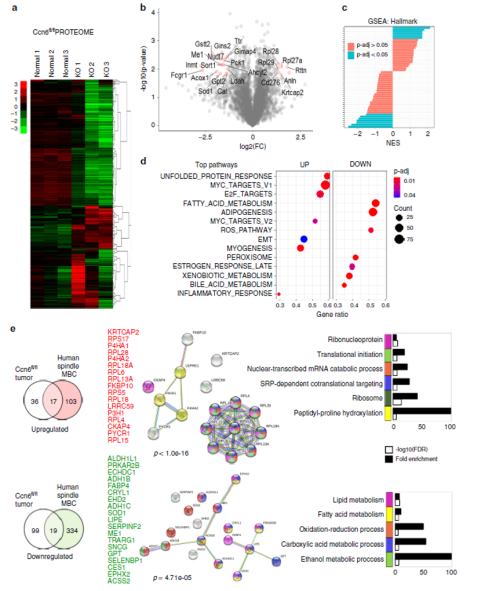
图8 小鼠MBC(MMTV-cre;Ccn6fl/fl)定量蛋白质组学分析
(Sabra I,et al. Nature Communications.2018.)
定量蛋白质组技术选择
蛋白质组(Proteome) 指由一个基因组(Genome),或一个细胞、组织表达的所有蛋白质(protein)。蛋白质是生命活动的体现者,所以,对于肿瘤疾病的研究,蛋白质组的研究将会是不二的选择。可用于筛选和寻找任何因素引起的样本之间的差异表达蛋白,结合生物信息学揭示细胞生理病理功能,同时也可对某些关键蛋白进行定性和定量分析。
定量蛋白质组技术推荐与选择:

参考文献:
[1]Sabra I.Djomehri,Maria E.Gonzalez,et al.Quantitative proteomic landscape of metaplastic breast carcinoma pathological subtypes and their relationship to triple-negative tumors. J Exp Clin Cancer Res 37,322 (2018).
博翀生物
广州博翀生物科技有限公司为体必康集团子公司,同时也是中科院生物物理所成果转化的标杆企业之一。博翀生物是以系列蛋白芯片产品、质谱蛋白质组学(iTRAQ、TMT、DIA等产品)、代谢组学产品及其整体科研解决方案等为特色,整合科技、临床和产业资源,为科研和转化创新领航的高科技企业。